Wie werden Biosimilars zugelassen?
Biosimilars durchlaufen einen verkürzten Entwicklungspfad
Fresenius Kabi ist sich der Bedeutung von Biosimilars bewusst und setzt sich für eine effektive und sichere Behandlung von Patienten ein. Damit Biosimilars zugelassen werden können, müssen sie von der FDA und der EMA eine Reihe von strengen Tests bestehen. Spezifische Ähnlichkeiten mit dem Referenzprodukt müssen in den folgenden Tests nachgewiesen werden:
Analytische Studien: Nachweis, dass Biosimilars sehr ähnliche molekulare und funktionelle Eigenschaften aufweisen wie das zugelassene Referenzprodukt.
Klinische Studien: Bestätigung der äquivalenten Wirksamkeit, Verträglichkeit, Pharmakokinetik und Pharmakodynamik im direkten Vergleich mit dem Referenzprodukt in einer geeigneten Patientenpopulation und sensitiven Indikation.
Biosimilar-Entwicklung
Nachweis, dass das Biosimilar dem Referenzprodukt sehr ähnlich ist.

Bei der Entwicklung von Biosimilars liegt der Schwerpunkt auf der molekularen Charakterisierung und Analyse. Ein massgeschneidertes klinisches Studienprogramm dient dazu die Biosimilarität zu bestätigen.
Biosimilars durchlaufen einen verkürzten Entwicklungsprozess. Wenn der Nachweis erbracht ist, dass ein Biosimilar dem Referenzprodukt biosimilar, d. h. sehr ähnlich ist, dann ist es wissenschaftlich gerechtfertigt, sich im Rahmen des Zulassungsprozesses auf bestimmte vorhandene Erkenntnisse und Erfahrung hinsichtlich Sicherheit und Wirksamkeit des Referenzprodukts zu stützen.
Der verkürzte Entwicklungsprozess ermöglicht ein potenziell schnelleres und kostengünstigeres Medikamentenentwicklungsprogramm für ein Biosimilar.
"Die in mehr als 10 Jahren klinischer Erfahrung gewonnenen Erkenntnisse zeigen, dass Biosimilars, die durch die EMA zugelassen sind, in allen ihren zugelassenen Indikationen genauso sicher und wirksam eingesetzt werden können wie andere biologische Arzneimittel." (Zitat EMA)
"Alle von der FDA zugelassenen biologischen Produkte, einschliesslich Referenzprodukte und Biosimilarprodukte, werden einer strengen Bewertung unterzogen, damit die Patienten hinsichtlich Wirksamkeit, Sicherheit und Qualität dieser Produkte sicher sein können.“ (Zitat FDA)
Zulassung von Biosimilars
Durch die Europäische Kommission wurde 2006 das erste Biosimilar zugelassen. In der EU müssen sich Biologika und Biosimilars über die EMA einem stark regulierten und kontrollierten zentralen Verfahren unterwerfen um zugelassen zu werden. Die Überprüfung durch die EMA führt zu einem wissenschaftlichen Gutachten, das dann an die Europäische Kommission weitergeleitet wird, die letztlich eine EU-weite Zulassung erteilen kann. Für die Zulassung von Biosimilars in der Schweiz ist wie im Fall von Generika Swissmedic, Heilmittelinstitut und schweizerische Zulassungsbehörde für Medikamente, zuständig. Das erste Biosimilar in der Schweiz wurde 2009 zugelassen.
Im Rahmen des Zulassungsverfahrens stützt sich die Entwicklung von Biosimilars im Wesentlichen auf direkte Vergleichsstudien, um die Biosimilarität mit dem Referenzprodukt zu ermitteln. Dabei werden das Biosimilar und das Referenzprodukt direkt miteinander verglichen. Dies geschieht über einen auf jedes Produkt zugeschnittenen, schrittweisen Prozess: Aus den ersten Qualitätsvergleichsstudien (Schritt 1) werden Umfang und Art der im nächsten Entwicklungsschritt erforderlichen nicht-klinischen (Schritt 2) und klinischen Studien (Schritt 3) ermittelt, um potentielle Unterschiede zwischen dem vorgeschlagenen Biosimilar und dem Referenzprodukt auszuschliessen.

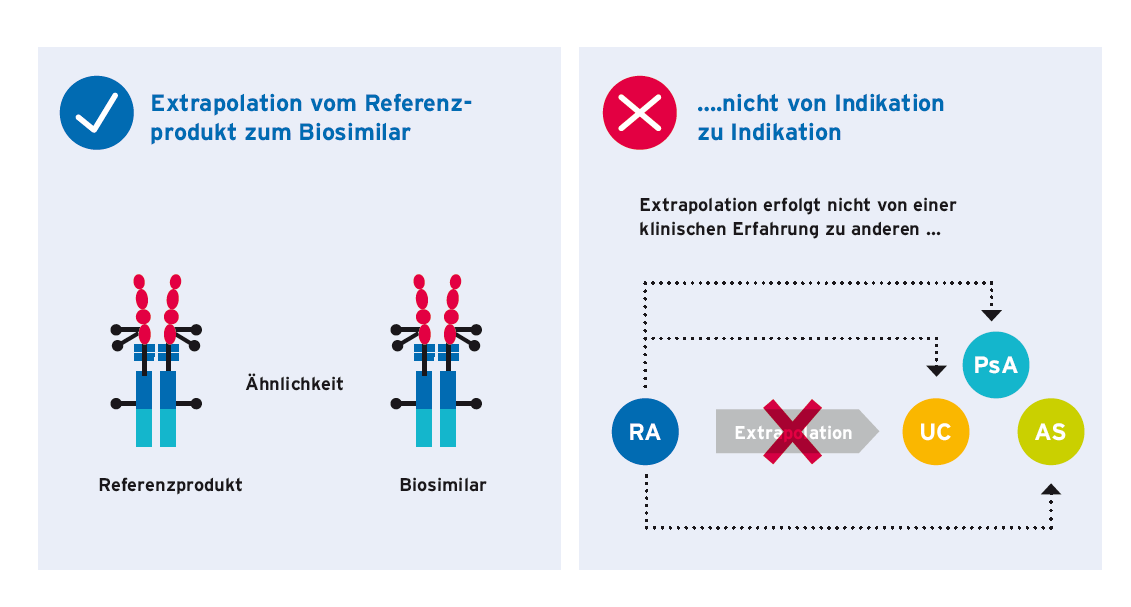
Das Konzept der Extrapolation bei Biosimilars
Beim Zulassungsprozess eines Biosimilars ist die Extrapolation der Wirksamkeits- und Sicherheitsdaten auf andere Indikationen des Referenzproduktes, für die keine klinische Vergleichbarkeit geprüft wurde, auf Basis der gesamten Datenlage und einer entsprechenden wissenschaftlichen Begründung möglich. Dies bedeutet, dass weniger klinische Studien oder keine Studien mit dem Biosimilar für bestimmte Indikationen durchgeführt werden müssen, was den Zulassungsprozess beschleunigt und den Patienten Zugang zu mehr Behandlungsmöglichkeiten ermöglicht. Die Extrapolation ist jedoch kein automatischer Prozess, sondern unterliegt strengen Auflagen. So muss in den verschiedenen Indikationen der Wirkmechanismus des Wirkstoffs gleich sein. Zudem muss sich aus der Gesamtheit der verfügbaren Daten zur strukturellen und funktionellen Charakterisierung des Biosimilars und klinischen Vergleichbarkeit in einer sensitiven Indikation mit dem Referenzprodukt, wissenschaftlich schlüssig belegen lassen, dass man von einer sehr ähnlichen Wirksamkeit und Verträglichkeit auch in jeweils extrapolierten Indikationen ausgehen kann. Ein höchst ähnliches Molekül wird sich auch in allen Indikationen und Patientengruppen höchst ähnlich verhalten.
Extrapolation auf andere Indikationen für Biosimilars